
Cell | 原始内胚层支持谱系可塑性
发布日期:2024-08-11 14:27 点击次数:68

早期胚胎的细胞具有适应和调节其命运以应对外界环境变化的能力。这种特征被称为可塑性,使细胞能够改变其分化轨迹,这是调节发育的标志。在小鼠中,二细胞阶段(2-cell-stage)的卵裂球能够从单个细胞产生一个完整的生物体【1,2】,此后,随着发育的推进,每个卵裂球的潜力逐渐受到限制【3-7】。
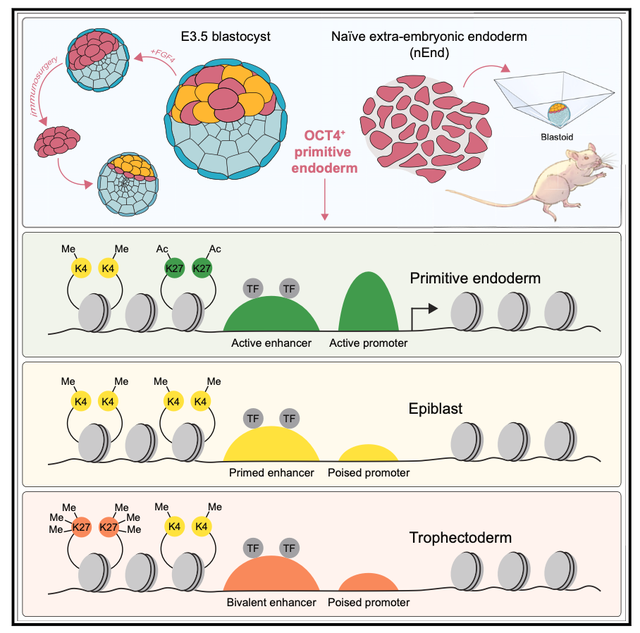
谱系特异性开始于桑葚胚压实后,形成环绕内细胞团(inner cell mass,简称ICM) 的胚外滋养外胚层 (trophectoderm,简称TE)。胚泡的形成伴随着FGF/ERK介导的ICM细胞向外胚层 (epiblast,简称Epi) 分化,外胚层产生胚胎本身,或者是胚外原始内胚层 (primitive endoderm,简称PrE,也称为下胚层),随后形成顶胚层(parietal endoderm,简称PE) 和内脏内胚层 (visceral endoderm,简称VE)。通过实验手段,PrE保持比Epi更长的可塑性窗口,并且在正常发育期间,可以观察到PrE-to-Epi细胞的命运转换,但从未观察到相反的情况。到囊胚后期,这种可塑性丧失,随后发生谱系定型。但是,PrE在细胞可塑性中的具体功能仍旧不清楚。
近日,来自丹麦University of Copenhagen的Joshua M. Brickman研究组在Cell上发表了文章The primitive endoderm supports lineage plasticity to enable regulative development,发现PrE虽然通常被认为是一个简单的支持组织,但它具有再生完整囊胚以及移植后发育的能力。

Oct4/Pou5f1是一种pou同源结构域转录因子 (transcription factor,简称TF),在体内和胚胎干细胞 (embryonic stem cells,简称ESCs) 中具备多能性,以及在TF介导的体细胞重编程到诱导多能干细胞 (induced pluripotent stem cells,简称iPSCs) 中发挥作用。OCT4最初在整个胚胎中表达,然后保留在早期Epi和PrE细胞中。体外诱导PrE同样也需要OCT4,其中OCT4与SOX17(而不是SOX2)协同促进内胚层基因的表达。在PrE分化期间,OCT4被限制在Epi,与囊胚成熟过程中可塑性的丧失相一致。
原始态ESCs是异质细胞系,且囊括了源于它们的ICM群体。这些细胞可以在多种条件下培养,包括含有血清的培养基中补充细胞因子LIF(leukemia inhibitory factor),以及含有LIF和GSK3和MEK抑制剂 (2iLIF),这说明早期Epi基态,同时还包含一群比例较少的ICM样细胞群。滋养干细胞 (Trophoblast stem cells,简称TSCs) 包括晚期TE、早期胚胎外胚层,以及类似于移植后PE的胚胎外内胚层(extra-embryonic endoderm,简称XEN) 细胞。作者之前描述了胚泡期PrE干细胞来源于初始ESCs,可以在LIF、Wnt和转化生长因子(TGF)-b信号的支持下扩增为原处胚外内胚层 (naive extra-embryonic endoderm,简称nEnd)。
作者发现单独的PrE足以再生一个完整的囊胚并继续植入后的发育。作者在体外鉴定了一个与早期PrE相似的细胞群体,在体内表现出相同的胚胎和胚胎外效力,并可以形成完整的基于干细胞的胚胎模型,称为囊胚。PrE定型被JAK/STAT信号抑制,并且接受OCT4和一组多能性相关转录因子的持续表达所调控,这些转录因子支持了一套允许多谱系分化的增强子。
虽然作者发现PrE在体内能够再生完整的胚胎,而nEnd在体外可以产生囊胚,但作者还没有证明,在缺乏大量小分子和生长因子的囊胚介质中,它们是否具有进一步发育和/或保持潜力。进一步的谱系追踪也需要明确证明PrE对胚胎发育后期和成年再生的贡献。在囊胚和TSC培养基中,nEnd分化为表达CDX2的TE样细胞,但当注入宿主胚胎时,整合在TE内的nEnd从不表达CDX2。这是因为它们从未成为真正的TE还是因为这些细胞需要时间来适应TE程序仍不清楚。
另外,作者只在一个物种中确定了PrE的可塑性,并确定了关键的TF Oct4,其持久性至关重要。需要多少TF,以及它们的阈值浓度是什么,这些问题仍然没有答案。
综上所述,作者的工作确定,转录因子是调控发育可塑性的基础,并强调了PrE在发育中的重要性,也就是PrE具有再生完整囊胚以及移植后发育的能力。
模式图(Credit: Cell)
参考文献
1 Nicholas, J.S., and Hall, B.V. (1942). Experiments on developing rats. II. The development of isolated blastomeres and fused eggs. J. Exp. Zool. 90, 441–459. https://doi.org/10.1002/jez.1400900307.
2 Tarkowski, A.K. (1959). Experiments on the Development of Isolated Blastomers of Mouse Eggs. Nature 184, 1286–1287. https://doi.org/10. 1038/1841286a0.
3 Handyside, A.H. (1978). Time of commitment of inside cells isolated from preimplantation mouse embryos. J. Embryol. Exp. Morphol. 45, 37–53. https://doi.org/10.1242/dev.45.1.37.
4 Rossant, J., and Lis, W.T. (1979). Potential of isolated mouse inner cell masses to form trophectoderm derivatives in vivo. Dev. Biol. 70, 255–261. https://doi.org/10.1016/0012-1606(79)90022-8.
5 Rossant, J., and Vijh, K.M. (1980). Ability of outside cells from preimplan- tation mouse embryos to form inner cell mass derivatives. Dev. Biol. 76, 475–482. https://doi.org/10.1016/0012-1606(80)90395-4.
6 Tarkowski, A.K., and Wro ́blewska, J. (1967). Development of blasto- meres of mouse eggs isolated at the 4- and 8-cell stage. J. Embryol. Exp. Morphol. 18, 155–180. https://doi.org/10.1242/dev.18.1.155.
7 Ziomek, C.A., Johnson, M.H., and Handyside, A.H. (1982). The develop- mental potential of mouse 16-cell blastomeres. J. Exp. Zool. 221, 345–355. https://doi.org/10.1002/jez.1402210310.
https://doi.org/10.1016/j.cell.2024.05.051
责编|探索君
排版|探索君
文章来源|“BioArt”
End